热应激一直是导致畜牧业出现重大经济损失的一个主要原因,它对奶牛有着多种负面影响,如生产性能降低、繁殖能力下降和免疫功能紊乱等。本文主要总结了热应激对奶牛免疫功能的影响,旨在为管理者提供适当的改进策略以维持热应激期间奶牛免疫系统功能的完整性提供帮助。
□尹诗 王维佳 刘正清 张强
李道全 杨志强 苏衍菁 杨卫兵
热应激是指当机体不能维持产热与散热间的平衡,产热大于散热时引起的机体的一种非特异防御性免疫应答。伴随全球气候变暖,极端高热天气流行率及强度大大增加,热应激给全球畜牧业造成的经济损失愈来愈严重。奶牛由于其皮肤表面汗腺不发达,并且在饲喂过程中,饲料在瘤胃中经过微生物发酵,及其妊娠阶段、泌乳阶段都会产生大量的代谢热,从而导致奶牛热应激的可能性大大增加。最新研究表明,美国乳制品协会每年都会因为奶牛热应激损失数十亿美元。
热应激在全球所有气候带均有可能发生,中国和美国的北部地区虽然气候温和,夏季短暂,气温不高,但这些地区的奶牛仍然有可能发生热应激。温湿度指数(THI)是一种结合了环境温度和相对湿度影响的计算指数,它描述了致使机体热应激的外界环境条件。THI指数最初是由Thom引入的,用于描述环境温湿度对人类的影响,但现在已被广泛应用于描述导致奶牛热应激的热条件。Armstrong将THI<71作为热舒适区(假设THI不会过低,导致奶牛冷应激),72—79为轻度热应激,80—90为中度热应激,>90为重度热应激。然而,上述绝对的THI值(取决于地理位置以及奶牛品种和体型)只能作为热应激对生产措施影响的粗略指标,并不能反映动物体内真实温度。此外,计算环境热应激取决于所选择的公式,而这些公式可以加权湿度或温度来考虑不同地区的环境条件。
当奶牛处于热中性区间(TNZ)时,饲喂成本最低,生产效率最高;此时,奶牛表现出最大的遗传潜力。热中性区间是一个狭窄的温度范围,在此温度范围内,动物不需要消耗能量就能维持正常体温。奶牛能够在较高的临界温度和较低的临界温度范围内调节体温。哺乳期奶牛热中性区间的温度范围为15℃—25℃。当环境温度达到最高临界温度时,奶牛就无法有效地调节体内温度,继而引发热应激。
影响奶牛热应激的因素有很多,包括遗传因素、饮食、健康及免疫状态等。奶牛作为反刍动物都是白天活动,晚上休息,与夜间相比,白天产热更多。此外,反刍动物在舍饲环境中需要花费大量时间进食和站立;饲喂之后,瘤胃内容物发酵以及营养物质的消化吸收都将产生大量代谢热能。倘若夜间环境温度和湿度对比白天没有显著下降的话,奶牛无法将白天产生的热能散发出去,就导致其处于热应激状态中。
热应激期间,下丘脑—垂体—肾上腺轴(HPA)和交感—肾上腺—髓质轴(SAM)活化,维持内环境稳态以对抗应激刺激。急性应激引起肾上腺分泌皮质醇增加,刺激免疫应答,而慢性应激期间皮质醇分泌的增加则会起到抑制免疫应答的作用,当机体免疫细胞的活化受到抑制时,动物更容易受到免疫挑战或疾病的影响。
在机体免疫反应中,先天性免疫反应和适应性免疫反应最为复杂,需要长期的免疫刺激才能发挥功能。尽管先天性免疫应答和适应性免疫应答功能差异很大,彼此间作用机制完全不同,但它们相互协调,相互合作,共同保护机体免受病原体或外界不良环境的侵害。众所周知,适应性免疫应答又分为体液免疫(HI)和细胞免疫(CMI);正常生理状态下,机体的体液免疫和细胞免疫处于一种动态平衡中,以确保免疫系统灵活有效,从而维持机体正常生理功能;然而,当机体处于热应激时,免疫系统很有可能会受到抑制。已有相关研究报道,热应激极大地抑制了白细胞介素-2基因的活性,而白细胞介素-2在T细胞增殖中起着至关重要的作用;因此,当奶牛经历热应激时,其免疫功能将显著减弱。
伴随着极端天气发生率和强度的增加,热应激对奶牛的影响越来越大。为了应对未来气候变化,我们需要制定适当的战略改善奶牛热应激,维持奶牛的健康、生产力和福祉。
热应激与奶牛免疫系统的相互作用
当奶牛暴露在热中性区以上的条件下时,容易产生热应激,致使奶牛采食量大幅下降,健康水平及免疫能力也会受到不同程度的影响。SAM和HPA轴在调节应激反应中发挥着至关重要的作用。该轴刺激皮质醇分泌增加,从而对奶牛免疫系统起到一定的抑制作用。热应激引起相关细胞因子释放继而诱导糖皮质激素产生,同时,糖皮质激素也可以抑制细胞因子的产生,这可能是一种保护机制,旨在防止过度的免疫抑制;糖皮质激素通过抑制IL-12活性继而影响T-辅助性1细胞(Th1)和T-辅助性2细胞(Th2)的平衡,而儿茶酚胺则抑制IL-12分泌并增强IL-10的产生。因此,糖皮质激素和儿茶酚胺可能会抑制细胞免疫并诱导免疫应答优先向Th2介导的体液免疫的转移。
目前人们普遍认为,外界不良环境抑制机体的免疫功能,增加了机体对各类疾病的易感性。热应激通过活化信号通路转导方式,调节免疫细胞在mRNA水平上的基因表达模式,从而激活热休克反应,最终改变了相关细胞因子活性。不同的细胞因子表达模式促进了Th1或Th2细胞的分化,Th1细胞激活细胞免疫和炎症反应,而Th2细胞调节体液免疫并促进抗炎反应。动物选择性产生Th1细胞因子(IFN-γ和IL-12)和Th2细胞因子(IL-10、IL-4、IL-13)的能力是调节Th1:Th2细胞因子平衡的重要组成部分。热应激与Th1细胞因子的下调和Th2细胞因子的上调相关,从而抑制细胞免疫。热应激还能通过促进皮质醇的释放抑制细胞免疫应答,皮质醇能与DNA结合抑制T细胞活化和相关细胞因子基因的表达。
热应激对奶牛免疫应答的影响
热应激与畜禽的健康问题密切相关,也与畜禽免疫应答受限相关。在热应激期间接种疫苗可能无法产生最佳的免疫反应,继而导致疫苗失效。热应激破坏了机体对外来病原体的天然屏障,并且使体内内毒素水平迅速升高,这可能对目标细菌全细胞疫苗的接种产生不利影响。此外,热应激时释放的糖皮质激素可降低免疫反应的记忆性,从而对疫苗接种产生负面影响。慢性热应激可以上调CD4+、CD25+、Foxp3+、IL-10和TGF-β来增加机体对病原微生物的易感性,这可能与适应性免疫反应受限有关。
奶牛热应激期间影响免疫反应的分子机制
热应激引起诸多生理变化以及细胞自适应能力加强,以试图抵消热应激期间的负面影响,保护机体功能正常运转。这些机制有助于消除特异性或非特异性病原体。皮质醇可有效地消除热应激反应,并具有一定的抗炎作用,而儿茶酚胺被认为具有炎症作用。因此,热应激通过刺激HPA和SAM轴对免疫反应产生负面影响,随后刺激初级和次级淋巴器官,导致抗体、细胞毒性细胞、细胞因子、趋化因子和热休克蛋白(HSPs)的产生。应激蛋白如热休克蛋白、nod样受体(NLRs)、toll样受体(TLRs)、RIG-I样受体(rlr)、c型凝集素受体(CLRs)、aim2样受体(ALRs)、细胞因子和趋化因子等基因在免疫系统的调控中也起着至关重要的作用。
皮质醇通过靶向与细胞因子、趋化因子、炎症蛋白及其受体以及细胞黏附相关的基因来调节免疫系统。在转录水平上,皮质醇与糖皮质激素受体结合,抑制激活蛋白-1(AP-1)和NF-κB的转录活性,从而调节各种细胞因子的表达。当皮质醇浓度增加并与其受体结合时,会对免疫系统产生抑制作用,这与抑制免疫细胞的抗炎作用有关。
在体外条件下,暴露于39℃和41℃的多形核细胞其caspase-3和caspase-7活性无明显变化;但暴露于41℃以上时,caspase-3和caspase-7活性变化明显。Min等研究表明,奶牛在热应激状态下,其体内有85种蛋白质的表达模式存在显著差异,补体成分C1、C3、C5、C6、C7、C8和C9以及补体因子B和补体因子H下调。以上结果表明,奶牛免疫系统在热应激条件下受到一定程度的损害,乳房内的免疫系统因细胞免疫受到抑制而受损,继而导致感染、乳腺细胞凋亡和产奶量减少。
细胞内热休克蛋白,特别是HSP70和HSP90,除了作为分子伴侣外,还参与抗原递呈及加工。热休克蛋白与细胞质抗原肽相关,并有助于肽的易位和加工。HSP70蛋白家族与抗原加工相关的转运蛋白(TAP)有关,在其将抗原肽从细胞质运输到内质网的过程中还需要ATP供能。热休克蛋白也与TLR通路相关,其中HSP70和HSP60可通过刺激TLR4诱导树突状细胞(DC)增殖。患处受损细胞释放热休克蛋白,激活DC,通过分泌炎性细胞因子诱导机体炎症反应。热应激持续时间的增加将导致更多细胞受损,这是因为细胞外热休克蛋白和先天免疫应答的强化呈正相关,表明了热休克蛋白在增强先天免疫应答中发挥着重要功能。
热应激与奶牛先天免疫应答
免疫系统根据不同的外界环境或病原体刺激,活化的部分不同,当机体暴露于感染环境中或处于免疫挑战时,先天免疫应答作为第一道防线能有效保护机体免受侵害;它主要由物理屏障组成,如皮肤和黏膜、黏膜分泌物、唾液、尿液、泪液、消化酸和阴道酸等。若外界病原体突破机体的第一道屏障侵入机体时,中性粒细胞、血液中的单核细胞和组织中的巨噬细胞在先天免疫系统的诱导下向感染部位迁移,然后通过各种细胞表面受体检测外来病原体,当检测到病原体之后,这些细胞就会通过内溶酶体途径吞噬并杀死致病微生物。
淋巴细胞与机体内多种免疫功能都密切相关,它能调节免疫球蛋白的生成,进而加强机体免疫防御。Elvinger等人报道,与38.5℃相比,在体外高温(42℃)条件下培养荷斯坦牛淋巴细胞60小时后,其增殖能力明显下降。此外,在40℃下培养时,荷斯坦牛淋巴细胞计数也显著减少,中性粒细胞计数则增加。
热应激对奶牛细胞免疫反应的影响
适应性免疫应答主要包括体液免疫和细胞免疫。目前关于热应激对奶牛细胞免疫影响的研究尚无准确定论。在体内条件下,奶牛和水牛的外周血单核细胞(PBMC)在热应激条件下受到影响,反应性因动物的生理状态而异。在温带气候条件下,炎热的天气促使了奶牛体内PBMC的增殖。在体外热应激条件下,有丝分裂原刺激培养后的奶牛淋巴细胞增殖能力下降。同样,Kamwanja等人报道,牛淋巴细胞45℃体外培养3小时,活细胞数量显著减少,PBMC对有丝分裂原的反应性大大降低。牛淋巴细胞在热应激期间功能受损可能与细胞免疫力下降有关,Th1和Th2平衡被打破,促使Th2细胞因子的分泌,最终影响淋巴细胞增殖。这表明在体外条件下,热应激能够抑制T细胞有丝分裂原Con A介导的淋巴细胞增殖。
热应激对奶牛体液免疫反应的影响
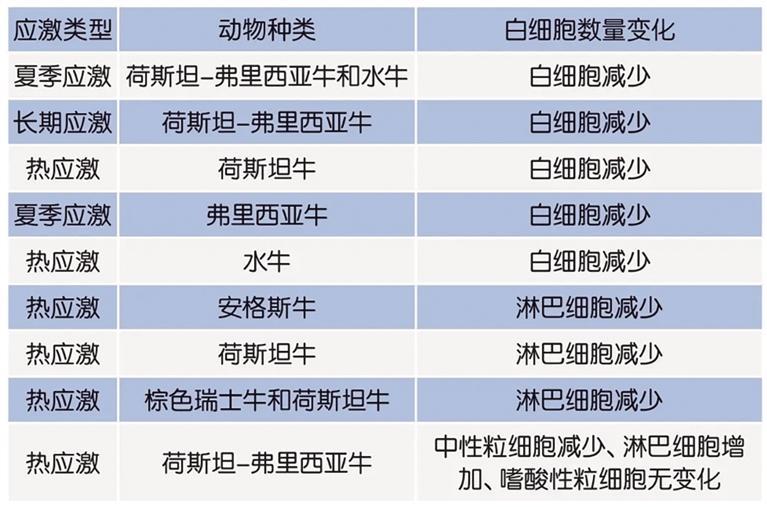
热应激与泌乳牛产奶量下降、繁殖率下降和疾病发病率增加呈正相关。据报道,干奶期奶牛的热应激会导致其产奶量显著下降,并且损害干奶期的乳房免疫功能。妊娠后期的高环境温度也会影响母牛的被动免疫向犊牛转移,暴露于热应激下的犊牛血清IgG水平低于低温环境下的犊牛。这表明,处于热应激状态下的犊牛接受母牛被动免疫转移功能受到损害,这可能与出生后肠道中IgG吸收受损有关。此外,Nardone等人也报道了热应激奶牛初乳中IgG含量较低(低22.3%)。然而,Shearer等人观察到,暴露在夏季自然高温下的奶牛初乳中IgG的浓度高于其他季节的奶牛。表1描述了热应激对奶牛体液免疫系统的影响。
Godden报道,奶牛在妊娠后期经历热应激时初乳质量降低,IgG、IgA浓度降低,总蛋白、酪蛋白、乳蛋白、脂肪和乳糖含量降低。同样,Adin等人报道,经历热应激的荷斯坦干奶牛在随后的泌乳阶段中产奶量和IgG含量降低。Bernabucci等报道称,热应激下奶牛的初乳酪蛋白、乳白蛋白含量降低,IgG和IgA浓度也降低,但乳球蛋白百分比和IgM浓度不变。初乳的这些变化可能归因于热应激对DMI的负面影响,此时乳腺血流量减少,营养利用受阻,导致IgG和营养物质从血液循环转移到乳腺的机制受损,进而导致产生IgA的乳腺浆细胞的免疫反应受损。
热应激下如何提高奶牛免疫力
我们可以采取适当的管理策略,缓解生产动物的热应激,进而改善其免疫功能:①对环境进行物理改造;②改善营养管理;③开展耐热基因型的遗传和表型选择工作。必须以低纤维、最佳蛋白质和能量的优质饲料喂养动物;适当的能量、矿物质、维生素、抗氧化剂、益生元和益生菌与均衡营养的结合对于改善奶牛热应激十分重要。热应激期间,氨基酸在奶牛免疫应答中的作用举足轻重,产奶时氨基酸利用率降低,会导致免疫反应和糖异生受阻。此外,热应激期间在日粮中补充硒能有效降低奶牛临床型乳房炎的发病率和乳中体细胞数。在夏季,通过在奶牛日粮中补充锌,可以促进乳房角蛋白层角化,这可能与乳腺炎发病率降低有关。同样,在围产期间日粮中补充锌,可以降低血清中IL-6的水平继而减弱热休克蛋白反应,增强奶牛免疫力。铜和铁的补充则可有效促进免疫器官的发育,如胸腺、脾脏、淋巴结等的发育,并增强中性粒细胞和巨噬细胞的吞噬活性,而免疫细胞增殖及抗体生成必须要中性粒细胞和巨噬细胞参与。此外,Vivier等人研究表明,铬的补充有助于初级免疫反应中IgM和IgG的增加。
在体外条件下,热应激期间荷斯坦牛PMBC中IL-2增殖,Annexin V-bing和HSP70 mRNA蛋白表达量增加。在体内热应激条件下,添加酵母聚糖可提高热应激奶牛的生产性能和免疫力,主要表现是提高荷斯坦牛的DMI、产奶量,提高血清中IgA、IL-2、TNF-α的含量,降低肝脏中HSP70的表达和机体呼吸频率。
小结
热应激使牲畜禽免疫状态受到不良影响,急性热应激可能对免疫系统的活化有刺激作用,而慢性热应激则抑制免疫系统的活化。热应激诱导机体释放皮质醇,进而抑制了参与T细胞活化和细胞因子产生相关基因的表达,最终损害细胞免疫功能。因此,皮质醇在奶牛热应激期间的抗炎反应和免疫抑制作用的调节中具有重要作用。此外,热应激同时也抑制了细胞免疫和体液免疫,使机体无法有效维持免疫系统的动态平衡。综上所述,奶牛在热应激情况下,抗体、细胞因子、趋化因子和热休克蛋白生成受阻,从而对其免疫应答产生不利影响。